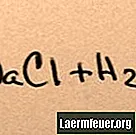
Conţinut
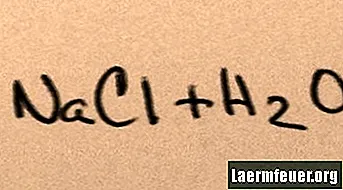
Când sarea se adaugă în apă, aceasta se dizolvă în moleculele sale componente până când ionii de sare maximi pe care îi poate susține apa plutesc în jurul moleculelor de hidrogen și oxigen. Când se întâmplă acest lucru, soluția este numită „saturată”. Când se dizolvă mai multă sare, ionii de sodiu și clorură se ciocnesc între ei și se recombină în cristale de sare. Acest fenomen este cunoscut sub numele de „precipitații”, deoarece solidul format cade pe fundul apei. Sărurile sunt „hidrofile”, adică sunt atrase de apă. Această atracție facilitează o formă familiară de precipitații: picăturile de ploaie se formează în jurul unor mici cristale de sare din nori, făcându-l să aibă un gust ușor sărat.
Baza

Electroliti

Sarea nu conduce electricitatea în stare solidă, dar în stare fluidă (lichidă) formează o soluție care poate conduce electricitatea foarte bine. Conductivitatea depinde de tipul de sare utilizată, dar aceste lichide, numite soluții de electroliți, sunt purtători excelenți ai compușilor necesari organismului uman. Impulsurile electrice generate de creier produc oxigen liber, care este utilizat de sânge. Moleculele de sare sunt clasificate în electroliți (sodiu, potasiu sau calciu) și cloruri în soluție: clorura este pompată de sânge și rinichi în urină, iar electroliții sunt distribuiți prin sistemul neuromuscular într-un proces pe care sportivii îl numesc rehidratare.
Proprietati coligative

Orice soluție diferă de compoziția sa originală, deoarece adăugarea de molecule, chiar și atunci când acestea nu formează compuși noi, modifică greutatea moleculară a lichidului și îi afectează proprietățile. Apa sărată este mai densă decât apa pură și, de asemenea, îngheață mai lent. Pe măsură ce îngheață, sarea migrează la limitele lichidului, făcându-l mai greu și mai saturat și apoi scăzând punctul său de îngheț. La celălalt capăt al stării materiei, cu cât apa sărată este mai densă, cu atât este nevoie de mai multă căldură pentru a se evapora, până când apa se scurge, lăsând un strat de sare. Bucătarii așteaptă să fiarbă apa din oală pentru a adăuga sare, pentru a nu întârzia încălzirea. Aceste calități, cunoscute sub numele de „proprietăți coligative”, îi ajută pe oamenii de știință să determine greutatea moleculară a apei sărate. Dacă masa, presiunea atmosferică și punctul de fierbere al lichidului pot fi măsurate, oamenii de știință pot scădea greutatea moleculară a apei pentru a afla care săruri sunt prezente.