Conţinut
- Numărul de electroni din carcasa de valență
- Pasul 1
- Pasul 2
- Pasul 3
- Pasul 4
- Structura lui Lewis
- Pasul 1
- Pasul 2
- Pasul 3
- Sarcina formală a fiecărui atom
- Pasul 1
- Pasul 2
- Pasul 3
Atunci când se determină încărcarea formală a unei molecule precum CoCl2 (gaz fosgen), este necesar să se cunoască numărul de electroni din stratul de valență al fiecărui atom și structura Lewis a moleculei.
Numărul de electroni din carcasa de valență
Pasul 1
Căutați fiecare atom din tabelul periodic al elementelor pentru a determina numărul de electroni din învelișul de valență.
Pasul 2
Amintiți-vă că doi electroni sunt la primul sub-nivel s, doi sunt la al doilea sub-nivel s, șase electroni la primul sub-nivel p etc. Amintiți-vă: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Pasul 3
Loveste sarcina. Dacă molecula este un ion, se adaugă sau se scade unul sau mai mulți electroni din total pentru a ajunge la sarcina finală.
Pasul 4
Pentru CoCl2 (gaz fosgen): C = 4; O = 6; Cl = 7. Molecula nu este ionizată și are o sarcină neutră. Prin urmare, numărul total de electroni din carcasa de valență este de 4 + 6 + (7x2) = 24.
Structura lui Lewis
Pasul 1
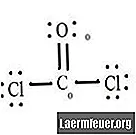
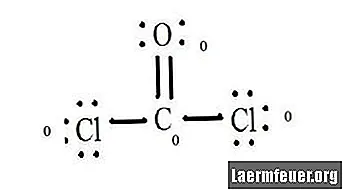
Vezi diagrama structurii Lewis a CoCl2 (gaz fosgen). Structura Lewis reprezintă cea mai stabilă și probabilă structură a moleculei. Atomii sunt atrași cu electroni de valență împerecheați; legăturile se formează între electroni liberi pentru a satisface regula octetului.
Pasul 2

Desenați fiecare atom și electronii săi de valență și apoi formați legături după cum este necesar.
Pasul 3
Atomii de clorură împart legături simple cu molecula de carbon, în timp ce atomul de oxigen formează o legătură dublă cu carbonul. Fiecare atom din structura finală îndeplinește regula octetului și are opt electroni în învelișul de valență, permițând stabilitatea moleculară.
Sarcina formală a fiecărui atom
Pasul 1
Numărați perechile fără electroni ale fiecărui atom din structura Lewis. Fiecărui atom i se atribuie un electron din fiecare legătură la care participă. Adăugați acele numere. În CoCl2: C = 0 perechi libere plus 4 electroni de legături = 4 electroni. O = 4 electroni de perechi libere plus 2 electroni de legături = 6 electroni. Cl = 6 electroni de perechi libere plus un electron al unei legături cu C = 7 electroni.
Pasul 2
Scădeți cantitatea numărului de electroni din carcasa de valență din atomul nelegat. Rezultatul este încărcarea formală pentru fiecare atom. În CoCl2: C = 4 electroni de valență (ev) în atomul nelegat minus 4 electroni desemnați în structura Lewis (LS) = 0 sarcină formală O = 6 ev - 6 LS = 0 sarcină formală Cl = 7 ev - 7 LS = 0 marfa formala
Pasul 3
Când scrieți, plasați aceste sarcini aproape de atomi în structura Lewis. Dacă molecula are o sarcină în total, așezați structura Lewis între paranteze cu sarcina scrisă în exterior în colțul din dreapta sus.