
Conţinut
Numărul de ioni dintr-un compus depinde de structura compusului și de numerele de oxidare ale elementelor din interiorul acestuia. Numărul de oxidare al unui element este numărul de electroni pe care un atom are sau are nevoie în raport cu numărul de protoni din nucleul său. Aceasta determină încărcarea ionică a atomului, fiind esențială pentru a descrie compușii ionici pe care îi formează cu alți atomi
instrucțiuni de ghidare
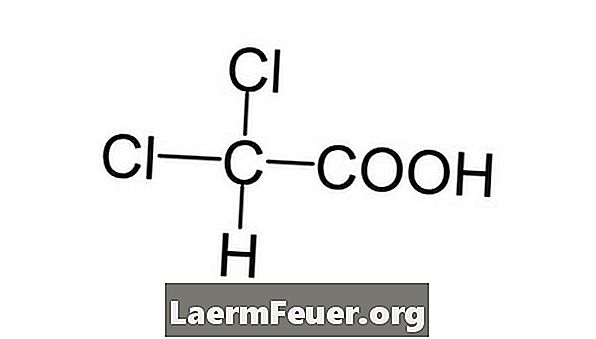
-
Scrieți formula chimică pentru compusul în cauză.
-
Identificați ionii poliatomici din compus. Ioniții poliatomici sunt molecule ionice formate din mai mult de un atom (de obicei, mai mult de un element). Vedeți referințele pentru lista ionilor poliatomici obișnuiți și încărcăturile lor.
-
Separați cationii și anionii. Cationii sunt ioni încărcați pozitiv, anionii sunt ioni încărcați negativ. De exemplu, FeSO (4) (sulfat de fier (II)) conține un cation de fier (Fe + 2) și un sulfat anionic (SO (4) -2). Este important de observat că sulfatul este un ion poliatomic și nu un set de cinci ioni diferiți. Numerele romane "II" indică numărul de oxidare +2 al fierului. Acest lucru îi permite să se lege cu un singur anion sulfat.
Dacă un simbol chimic are un exponent asociat cu acesta, există mai mulți atomi ai acelui element în compus. Dacă nu fac parte dintr-un ion poliatomic, fiecare atom al acelui element este un ion individual. De exemplu, sulfatul de fier (III) este scris ca Fe2 (SO4) 3. Numărul de oxidare +3 al fierului necesită un număr diferit de sulfați pe legătură ionică. În acest caz, doi ioni de fier se vor lega cu trei ioni de sulfat.
-
Adăugați numărul total de cationi și anioni. Sulfatul de fier (II), de exemplu, are doi ioni: cationul de fier și anionul sulfat.
sfaturi
- Având o înțelegere globală a numerelor de oxidare vă va ajuta să descifrați natura ionică a unui compus rapid și cu încredere.
Ce ai nevoie
- Tabel periodic