Conţinut
- instrucțiuni de ghidare
- Numărul de electroni din stratul de valență
- Structura lui Lewis
- Încărcare formală a fiecărui atom
- avertisment
- Ce ai nevoie
Atunci când se determină încărcarea formală a unei molecule cum ar fi CoCl2 (gazul fosgenic), este necesar să se cunoască numărul de electroni din stratul de valență al fiecărui atom și structura Lewis a moleculei.
instrucțiuni de ghidare

-
Căutați fiecare atom din tabelul periodic al elementelor pentru a determina numărul de electroni din stratul de valență.
-
Amintiți-vă că doi electroni sunt în primul sub-nivel s, doi sunt în al doilea sub-nivel s, șase electroni în primul sub-nivel p și așa mai departe. Amintiți-vă: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Trageți încărcătura. Dacă molecula este un ion, adăugați sau scădeți unul sau mai mulți electroni din total pentru a ajunge la încărcarea finală.
-
Pentru CoCl2 (gaz fosgenic): C = 4; O = 6; Cl = 7. Molecula nu este ionizată și are o încărcătură neutră. Prin urmare, numărul total de electroni din stratul de valență este 4 + 6 + (7x2) = 24.
Numărul de electroni din stratul de valență
-
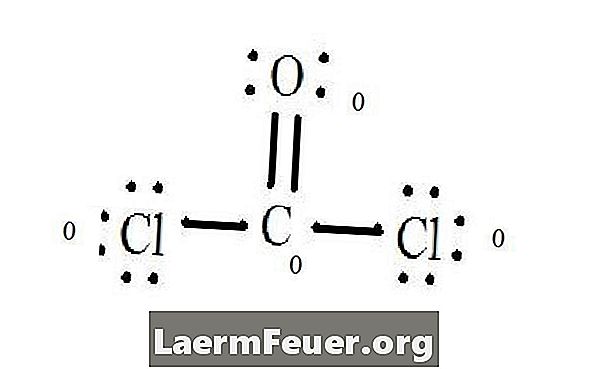
Vezi diagrama de structură Lewis a CoCl2 (gaz fosgenic). Structura lui Lewis reprezintă structura cea mai stabilă și probabilă pentru moleculă. Atomii sunt desenati cu electroni de valenta pereche; legăturile se formează între electronii liberi pentru a satisface regula octeților.
-
Desenați fiecare atom și electronii lui de valență și apoi formați legăturile după cum este necesar.
Electronii desenate pe structura lui Lewis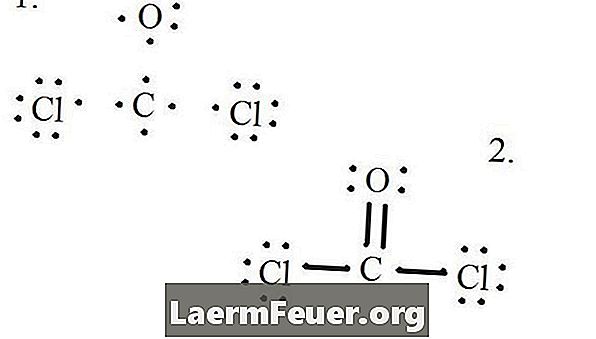
-
Atomii de clorură împărtășesc legături simple cu molecula de carbon, în timp ce atomul de oxigen formează o legătură dublă cu carbonul. Fiecare atom din structura finală satisface regula octetului și are opt electroni în stratul de valență, permițând stabilitatea moleculară.
Structura lui Lewis
-
Numără perechile electronilor liberi ai fiecărui atom din structura lui Lewis. Fiecare atom desemnează un electron al fiecărei legături din care participă. Adăugați aceste numere. În CoCl2: C = 0 perechi libere plus 4 electroni de legătură = 4 electroni. O = 4 electroni de perechi libere plus 2 electroni de legături = 6 electroni. Cl = 6 electroni de perechi libere plus un electron de o legătură cu C = 7 electroni.
-
Se scade cantitatea de electroni din stratul de valență pe atomul nelegat. Rezultatul este sarcina formală pentru fiecare atom. În electronii de valență CoCl2: C = 4 (ev) în atomul nelegat minus 4 electroni desemnați în structura Lewis (LS) = 0 sarcina oficială O = 6 ev - 6 LS = 0 sarcina oficială Cl = 7 și - Taxa oficială
Acuzațiile oficiale ale atomilor
-
Când scrieți, plasați aceste acuzații în apropierea atomilor din structura lui Lewis. Dacă în total moleculă are încărcătură, plasați structura Lewis în paranteze cu încărcătura scrisă în exterior în colțul din dreapta sus.
Încărcare formală a fiecărui atom
avertisment
- Calculul încărcăturii formale pentru moleculele care conțin metale tranziționale poate fi trădător. Numărul de electroni din stratul de valență pentru metalele tranziționale va fi cel din modelul de gaz nobil.
Ce ai nevoie
- Tabelul periodic al elementelor